
Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
Äggstock
Medicinsk expert av artikeln
Senast recenserade: 04.07.2025

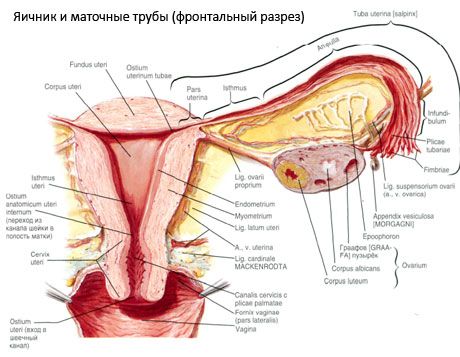
Äggstocken (ovarium; grekiska oophoron) är ett parat organ, en kvinnlig reproduktionskörtel, belägen i bäckenhålan bakom livmoderns breda ligament. I äggstockarna utvecklas och mognar kvinnliga reproduktionsceller (ägg), och kvinnliga könshormoner bildas som kommer in i blodet och lymfan. Äggstocken har en äggformad form, något tillplattad i anteroposterior riktning. Äggstockens färg är rosa. På ytan av äggstocken hos en kvinna som har fött barn är fördjupningar och ärr synliga - spår av ägglossning och omvandling av corpora lutea. Äggstocken väger 5-8 g. Äggstockens dimensioner är: längd 2,5-5,5 cm, bredd 1,5-3,0 cm, tjocklek - upp till 2 cm. Äggstocken har två fria ytor: den mediala ytan (facies medialis), som vetter mot bäckenhålan, delvis täckt av äggledaren, och den laterala ytan (facies lateralis), som gränsar till bäckenets sidovägg, till en lätt uttalad fördjupning - äggstocksgropen. Denna fossa är belägen i vinkeln mellan de yttre höftkärlen, täckta med peritoneum upptill, och livmoder- och obturatorartärerna nedtill. Bakom äggstocken passerar urinledaren på motsvarande sida retroperitonealt uppifrån och ner.
Äggstockens ytor övergår i en konvex fri (bakre) kant (margo liber), framtill - i mesenterikanten (margo mesovaricus), fäst med hjälp av en kort vik av bukhinnan (äggstockens mesenteri) till den bakre klaffen på livmoderns breda ligament. På denna främre kant av organet finns en spårad fördjupning - äggstockshilum (hilum ovarii), genom vilken artär och nerver kommer in i äggstocken, och vener och lymfkärl kommer ut. Äggstocken har också två ändar: den rundade övre rörformiga änden (extremitas tubaria), som vetter mot äggledaren, och den nedre livmoderänden (extremitas utenna), som är förbunden med livmodern genom äggstocksligamentet (lig. ovarii proprium). Detta ligament, i form av en rund snöre, cirka 6 mm tjock, går från äggstockens livmoderände till livmoderns laterala vinkel, som ligger mellan de två klaffen på livmoderns breda ligament. Äggstockens ligamentapparat inkluderar även äggstockens ligamentupphängning (lig.suspensorium ovarii), som är ett veck i bukhinnan som löper från bäckenväggen till äggstocken och innehåller äggstockskärlen och buntar av fibrösa fibrer inuti. Äggstocken är fixerad av ett kort mesenterium (mesovarium), som är en duplikering av bukhinnan som löper från den bakre delen av livmoderns breda ligament till äggstockens mesenteriska kant. Själva äggstockarna är inte täckta av bukhinnan. Äggledarens största äggstocksfrans är fäst vid äggstockens rörformiga ände. Äggstockens topografi beror på livmoderns position, dess storlek (under graviditeten). Äggstockarna är mycket rörliga organ i det lilla bäckenet.
Äggstockens kärl och nerver
Blodförsörjningen till äggstockarna tillhandahålls av aa. et vv. ovaricae et uterinae. Båda äggstocksartärerna (aa. ovaricae dextra et sinistra) utgår från aortas främre yta strax under njurartärerna; den högra utgår vanligtvis från aorta och den vänstra från njurartären. Varje äggstocksartär riktas nedåt och i sidled längs den främre ytan av psoas major-muskeln och korsar urinledaren framför (och avger grenar till den), de yttre höftkärlen, gränslinjen och går in i bäckenhålan, där den är belägen i äggstockens upphängningsligament. I mediala riktning passerar äggstocksartären mellan bladen på livmoderns breda ligament under äggledaren, avger grenar till den och sedan in i äggstockens mesenterium; den går in i äggstockens hilum.
Äggstocksartärens grenar anastomoserar i vid uterusartärens äggstocksgrenar. Venöst utflöde från äggstockarna sker huvudsakligen in i äggstockarnas venplexus, som är belägen i området kring äggstockshilum. Härifrån passerar blodutflödet i två riktningar: genom livmoder- och äggstocksvenerna. Den högra äggstocksvenen har klaffar och rinner ut i den nedre hålvenen. Den vänstra äggstocksvenen rinner ut i vänster njurven, även om den saknar klaffar.
Lymfdränage från äggstockarna sker genom lymfkärlen, särskilt rikligt i området kring organporten, där den subovariella lymfplexusen utmärks. Därefter utsöndras lymfan längs äggstockarnas lymfkärl till de paraaorta lymfkörtlarna.
Innervation av äggstockarna
Sympatisk - tillhandahålls av postganglionära fibrer från celiac (solar), superior mesenteric och hypogastric plexus; parasympatisk - av de viscerala sakralnerverna.
Äggstockens struktur
Äggstockens yta är täckt av ett enkelskiktat germinalt epitel. Under det ligger ett tätt proteinhölje av bindväv (tunica albuginea). Äggstockens bindväv bildar dess stroma (stroma ovarii), rik på elastiska fibrer. Äggstockens substans, dess parenkym, är uppdelad i yttre och inre lager. Det inre lagret, beläget i mitten av äggstocken, närmare dess port, kallas märgen (medulla ovarii). I detta lager, i lös bindväv, finns många blod- och lymfkärl och nerver. Äggstockens yttre lager - cortex (cortex ovarii) - är tätare. Det innehåller mycket bindväv, i vilken de mogna primära äggstocksfolliklarna (folliculi ovarici primarii), sekundära (vesikulära) folliklar (folliculi ovarici secundarii, s.vesiculosi) finns, samt mogna folliklar, Graafska folliklarna (folliculi ovarici maturis), samt gula och atretiska kroppar.
Varje follikel innehåller en kvinnlig reproduktionsäggcell, eller oocyt (ovocytus). Äggcellen är upp till 150 µm i diameter, rund, innehåller en cellkärna, en stor mängd cytoplasma, som förutom cellorganeller innehåller protein-lipidinneslutningar (äggula), glykogen, som är nödvändiga för äggcellens näring. Äggcellen förbrukar vanligtvis sitt näringstillförsel inom 12-24 timmar efter ägglossningen. Om befruktning inte sker dör äggcellen.
Det mänskliga ägget har två membran som täcker det. Inuti finns cytolemma, som är äggets cytoplasmatiska membran. Utanför cytolemma finns ett lager av så kallade follikulära celler, som skyddar ägget och utför en hormonbildande funktion - de utsöndrar östrogener.
Livmoderns, äggledarnas och äggstockarnas fysiologiska position tillhandahålls av de upphängande, fixerande och stödjande apparater som förenar bukhinnan, ligamenten och bäckenvävnaden. Den upphängande apparaten representeras av parade formationer, den inkluderar livmoderns runda och breda ligament, äggstockarnas egentliga ligament och upphängande ligament. Livmoderns breda ligament, äggstockarnas egentliga och upphängande ligament håller livmodern i mittläget. De runda ligamenten drar livmoderns fundus framåt och ger dess fysiologiska lutning.
Fixeringsapparaten (förankringsapparaten) säkerställer livmoderns position i mitten av det lilla bäckenet och gör det praktiskt taget omöjligt för den att förskjutas åt sidorna, fram och tillbaka. Men eftersom ligamentapparaten utgår från livmodern i dess nedre del är livmoderns lutningar i olika riktningar möjliga. Fixeringsapparaten innefattar ligament som är belägna i bäckenets lösa vävnad och sträcker sig från livmoderns nedre del till bäckenets laterala, främre och bakre väggar: sakromagiska, kardinala, uterovesikala och vesikopubiska ligament.
Förutom mesovariumet utmärks följande äggstocksligament:
- äggstockens upphängningsligament, tidigare betecknat som det infundibulopelviska ligamentet. Det är ett veck i bukhinnan med blodkärl (a. et v. ovarica) och lymfkärl samt äggstockens nerver som passerar genom det, utsträckt mellan bäckenets laterala vägg, ländryggsfascian (i det område där den gemensamma höftpulsådern delas in i yttre och inre) och äggstockens övre (tubala) ände;
- Äggstockens egentliga ligament går mellan bladen på det breda livmoderligamentet, närmare det bakre bladet, och förbinder äggstockens nedre ände med livmoderns laterala kant. Äggstockens egentliga ligament är fäst vid livmodern mellan äggledarens början och det runda ligamentet, bakom och ovanför det senare. I ligamentets tjocklek går rr. ovarii, vilka är de terminala grenarna av livmoderartären;
- Appendikulärt-ovariellt ligament Ligamentet sträcker sig från blindtarmen till höger äggstock eller livmoderns breda ligament i form av ett veck i bukhinnan. Ligamentet är inkonstant och observeras hos 1/2–1/3 av kvinnorna.
Stödapparaten representeras av bäckenbottenmusklerna och fascian, uppdelad i nedre, mellersta och övre (inre) lager.
Det kraftfullaste är det övre (inre) muskellagret, representerat av den parade muskeln som lyfter anus. Det består av muskelknippen som sprider sig från svanskotan till bäckenbenen i tre riktningar (pubococcygeus, iliococcygeus och ischiococcygeus). Detta muskellager kallas också bäckendiafragma.
Det mellersta muskellagret ligger mellan symfysen, blygdbenet och sittbenet. Det mellersta muskellagret - urogenitala diafragman - upptar den främre halvan av bäckenöppningen, genom vilken urinröret och slidan passerar. I den främre delen, mellan dess lager, finns muskelknippen som bildar urinrörets yttre slutmuskel, i den bakre delen finns muskelknippen som går i tvärriktningen - den djupa tvärgående muskeln i perineum.
Det nedre (yttre) lagret av bäckenbottenmusklerna består av ytliga muskler, vars form liknar siffran 8. Dessa inkluderar den bulbocavernösa, ischiocavernösa, yttre analsfinktern och den ytliga tvärgående perinealmuskeln.
Ontogenes av äggstockarna
Processen med follikeltillväxt och atresi börjar vid 20 veckors graviditet, och vid tidpunkten för förlossningen finns upp till 2 miljoner äggceller kvar i flickans äggstockar. Vid menark minskar deras antal till 300 tusen. Under hela den reproduktiva perioden når högst 500 folliklar mognad och ägglossning. Den initiala tillväxten av folliklar är inte beroende av FSH-stimulering, är begränsad och atresi uppstår snabbt. Man tror att istället för steroidhormoner är lokala autokrina/parakrina peptider den huvudsakliga regulatorn av tillväxt och atresi av primära folliklar. Man tror att processen med follikeltillväxt och atresi inte avbryts av några fysiologiska processer. Denna process fortsätter i alla åldrar, inklusive den intrauterina perioden och klimakteriet, och avbryts av graviditet, ägglossning och anovulering. Mekanismen som utlöser follikeltillväxt och deras antal i varje specifik cykel är fortfarande oklar.
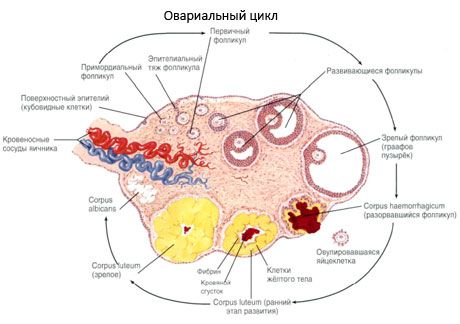
Under sin utveckling genomgår follikeln flera utvecklingsstadier. Primordiala könsceller utgår från endodermet i gulesäcken, allantois, och migrerar till embryots genitala område vid 5-6 graviditetsveckor. Som ett resultat av snabb mitotisk delning, som fortsätter från 6-8 veckor till 16-20 graviditetsveckor, bildas upp till 6-7 miljoner oocyter i embryots äggstockar, omgivna av ett tunt lager granulosaceller.
Preantral follikel - äggcellen är omgiven av ett membran (Zona pellucida). Granulosaceller som omger äggcellen börjar föröka sig, deras tillväxt är beroende av gonadotropiner och korrelerar med nivån av östrogener. Granulosaceller är måltavlan för FSH. I preantral follikelstadiet kan granulosaceller syntetisera tre klasser av steroider: inducerar huvudsakligen aktiviteten hos aromatas, det huvudsakliga enzymet som omvandlar androgener till östradiol. Man tror att östradiol kan öka antalet egna receptorer och utöva en direkt mitogen effekt på granulosaceller oberoende av FSH. Det anses vara en parakrin faktor som förstärker effekterna av FSH, inklusive aktivering av aromatiseringsprocesser.
FSH-receptorer uppträder på membranen i granulosacellerna så snart follikeltillväxten börjar. En minskning eller ökning av FSH leder till en förändring i antalet av dess receptorer. Denna verkan av FSH moduleras av tillväxtfaktorer. FSH verkar genom G-proteinet, adenylatcyklassystemet, även om steroidogenesen i follikeln huvudsakligen regleras av FSH, är många faktorer involverade i denna process: jonkanaler, tyrosinkinasreceptorer, fosfolipassystemet hos andra budbärare.
Androgeners roll i tidig follikelutveckling är komplex. Granulosaceller har androgenreceptorer. Dessa är inte bara ett substrat för FSH-inducerad aromatisering till östrogener, utan kan också förstärka aromatiseringen vid låga koncentrationer. När androgennivåerna ökar väljer preantrala granulosaceller företrädesvis inte aromatiseringsvägen till östrogener utan den enklare androgenvägen via 5a-reduktas för att omvandlas till ett androgen som inte kan omvandlas till östrogen, vilket hämmar aromatasaktiviteten. Denna process hämmar också FSH- och LH-receptorbildning, vilket stoppar follikelutvecklingen.
Aromatiseringsprocessen innebär att follikeln med höga androgennivåer genomgår atresi. Follikelns tillväxt och utveckling beror på dess förmåga att omvandla androgener till östrogener.
I närvaro av FSH kommer den dominerande substansen i follikelvätskan att vara östrogener. I frånvaro av FSH - androgener. LH är normalt frånvarande i follikelvätskan fram till mitten av cykeln. Så snart LH-nivån ökar minskar den mitotiska aktiviteten hos granulosacellerna, degenerativa förändringar uppstår och androgennivån i follikeln ökar. Nivån av steroider i follikelvätskan är högre än i plasma och återspeglar den funktionella aktiviteten hos äggstockscellerna: granulosa- och thecaceller. Om det enda målet för FSH är granulosaceller, har LH många mål - thecaceller, stromala och luteinceller samt granulosaceller. Både granulosa- och thecaceller har förmågan till steroidogenes, men aromatasaktivitet dominerar i granulosaceller.
Som svar på LH producerar thecaceller androgener, som sedan omvandlas av granulosaceller till östrogener genom FSH-inducerad aromatisering.
Allt eftersom follikeln växer börjar thecacellerna uttrycka gener för LH-receptorer, P450 sec och 3beta-hydroxysteroiddehydrogenas. Insulinliknande tillväxtfaktor (IGF-1) synergistiskt med LH ökar genuttrycket, men stimulerar inte steroidogenesen.
Ovariell steroidogenes är alltid LH-beroende. När follikeln växer uttrycker thecacellerna enzymet P450c17, vilket bildar androgener från kolesterol. Granulosaceller har inte detta enzym och är beroende av thecaceller för att producera östrogener från androgener. Till skillnad från steroidogenes är follikulogenes FSH-beroende. När follikeln växer och östrogennivåerna ökar aktiveras en återkopplingsmekanism - FSH-produktionen hämmas, vilket i sin tur leder till en minskning av follikelns aromatasaktivitet och i slutändan till follikelatresi genom apoptos (programmerad celldöd).
Återkopplingsmekanismen för östrogener och FSH hämmar utvecklingen av folliklar som har börjat växa, men inte den dominanta follikeln. Den dominanta follikeln innehåller fler FSH-receptorer, vilka stöder proliferationen av granulosaceller och aromatiseringen av androgener till östrogener. Dessutom fungerar de parakrina och autokrina vägarna som en viktig koordinator för antralfollikelutveckling.
Den autokrina/parakrina regulatorn består av peptider (inhibin, aktivin, follistatin), vilka syntetiseras av granulosaceller som svar på FSH och kommer in i follikelvätskan. Inhibin minskar FSH-sekretion; aktivin stimulerar frisättningen av FSH från hypofysen och förstärker FSH:s verkan i äggstocken; follistatin hämmar FSH-aktiviteten, möjligen genom att binda aktivin. Efter ägglossning och utveckling av corpus luteum är inhibin under kontroll av LH.
Tillväxten och differentieringen av äggstocksceller påverkas av insulinliknande tillväxtfaktorer (IGE). IGF-1 verkar på granulosaceller och orsakar en ökning av cykliskt adenosinmonofosfat (cAMP), progesteron, oxytocin, proteoglykan och inhibin.
IGF-1 verkar på thecacellerna och orsakar ökad androgenproduktion. Thecacellerna producerar i sin tur tumörnekrosfaktor (TNF) och epidermal tillväxtfaktor (EGF), vilka också regleras av FSH.
EGF stimulerar proliferationen av granulosaceller. IGF-2 är den viktigaste tillväxtfaktorn i follikelvätska, och IGF-1, TNF-α, TNF-3 och EGF finns också i den.
Störningar i parakrin och/eller autokrin reglering av äggstocksfunktionen verkar spela en roll vid ägglossningsstörningar och i utvecklingen av polycystiska äggstockar.
Allt eftersom den antrala follikeln växer ökar östrogenhalten i follikelvätskan. Vid toppen av deras ökning uppträder receptorer för LH på granulosacellerna, luteinisering av granulosacellerna sker och progesteronproduktionen ökar. Således, under den preovulatoriska perioden, orsakar en ökning av östrogenproduktionen uppkomsten av LH-receptorer, LH orsakar i sin tur luteinisering av granulosacellerna och progesteronproduktion. En ökning av progesteron minskar östrogennivåerna, vilket tydligen orsakar en andra topp av FSH i mitten av cykeln.
Ägglossning tros inträffa 10–12 timmar efter LH-toppen och 24–36 timmar efter östradioltoppen. LH tros stimulera minskad delning av oocyten, luteinisering av granulosaceller och syntes av progesteron och prostaglandin i follikeln.
Progesteron förstärker aktiviteten hos proteolytiska enzymer, vilka tillsammans med prostaglandin deltar i bristningen av follikelväggen. Den progesteroninducerade toppen av FSH gör att oocyten kan lämna follikeln genom att omvandla plasminogen till det proteolytiska enzymet plasmin, och ger ett tillräckligt antal LH-receptorer för normal utveckling av lutealfasen.
Inom 3 dagar efter ägglossningen ökar granulosacellerna i storlek, och karakteristiska vakuoler fyllda med pigmentet lutein uppträder i dem. Theca-lutealceller differentierar sig från theca och stroma och blir en del av corpus luteum. Kapillärer som penetrerar corpus luteum utvecklas mycket snabbt under inverkan av angiogenesfaktorer, och med förbättrad vaskularisering ökar produktionen av progesteron och östrogener. Steroidogenesens aktivitet och corpus luteums livslängd bestäms av nivån av LH. Corpus luteum är inte en homogen cellformation. Förutom 2 typer av lutealceller innehåller den endotelceller, makrofager, fibroblaster etc. Stora lutealceller producerar peptider (relaxin, oxytocin) och är mer aktiva i steroidogenes med större aromatasaktivitet och större syntes av progesteron än små celler.
Progesteronets topp inträffar på den 8:e dagen efter LH-toppen. Det noteras att progesteron och östradiol utsöndras episodiskt i lutealfasen i korrelation med den pulserande outputen av LH. Med bildandet av corpus luteum övergår kontrollen över inhibinproduktionen från FSH till LH. Inhibin ökar med ökningen av östradiol före LH-toppen och fortsätter att öka efter LH-toppen, även om östrogennivåerna sjunker. Även om inhibin och östradiol utsöndras av granulosaceller, regleras de av olika vägar. Minskningen av inhibin i slutet av lutealfasen bidrar till ökningen av FSH för nästa cykel.
Gulkroppen minskar mycket snabbt - på den 9:e-11:e dagen efter ägglossningen.
Degenerationsmekanismen är oklar och är inte relaterad till östrogeners luteolytiska roll eller till en receptorrelaterad mekanism, såsom observerats i endometriet. Det finns en annan förklaring till rollen av östrogener som produceras av corpus luteum. Det är känt att östrogener krävs för syntesen av progesteronreceptorer i endometriet. Östrogener i lutealfasen är förmodligen nödvändiga för progesteronrelaterade förändringar i endometriet efter ägglossning. Otillräcklig utveckling av progesteronreceptorer, som en följd av otillräckliga östrogennivåer, är möjligen en ytterligare mekanism för infertilitet och tidiga graviditetsförluster, en annan form av lutealfasbrist. Man tror att corpus luteums livslängd etableras vid tidpunkten för ägglossning. Och det kommer säkerligen att gå tillbaka om det inte stöds av humant koriongonadotropin på grund av graviditet. Således leder regression av corpus luteum till en minskning av nivåerna av östradiol, progesteron och inhibin. En minskning av inhibin tar bort dess hämmande effekt på FSH; En minskning av östradiol och progesteron möjliggör en mycket snabb återställning av GnRH-sekretion och borttagning av feedbackmekanismen från hypofysen. En minskning av inhibin och östradiol, tillsammans med en ökning av GnRH, ger upphov till FSH framför LH. En ökning av FSH leder till follikeltillväxt med efterföljande selektion av en dominant follikel, och en ny cykel börjar om graviditet inte inträffar. Steroidhormoner spelar en ledande roll i reproduktionsbiologi och allmän fysiologi. De bestämmer den mänskliga fenotypen, påverkar hjärt-kärlsystemet, benmetabolismen, huden, det allmänna välbefinnandet och spelar en nyckelroll under graviditet. Steroidhormonernas verkan återspeglar de intracellulära och genetiska mekanismer som är nödvändiga för att överföra en extracellulär signal till cellkärnan för att orsaka ett fysiologiskt svar.
Östrogener penetrerar diffust cellmembranet och binder till receptorer i cellkärnan. Receptor-steroidkomplexet binder sedan till DNA. I målcellerna leder dessa interaktioner till genuttryck, proteinsyntes och specifik cell- och vävnadsfunktion.
Использованная литература


 [
[