
Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
Cancerceller aktiverar omedelbart energiproduktion när DNA komprimeras och skadas
Senast recenserade: 03.08.2025
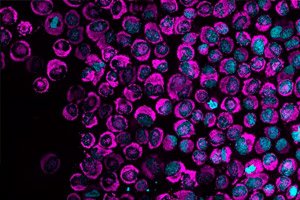
Cancerceller aktiverar omedelbart ett energirikt svar på fysisk kompression, enligt en studie publicerad i tidskriften Nature Communications. Denna energiutbrott är den första dokumenterade manifestationen av en skyddsmekanism som hjälper celler att reparera skadat DNA och överleva de trånga förhållandena i människokroppen.
Dessa fynd hjälper till att förklara hur cancerceller överlever i komplexa mekaniska miljöer, såsom att krypa genom tumörmikromiljöer, penetrera porösa blodkärl eller övervinna chocker i blodomloppet. Upptäckten av mekanismen kan leda till nya strategier för att "förankra" cancerceller innan de sprider sig.
Forskare vid Centre for Genomic Regulation (CRG) i Barcelona gjorde upptäckten med hjälp av ett specialiserat mikroskop som kan pressa levande celler till bara tre mikrometer bredd – ungefär trettio gånger mindre än diametern på ett mänskligt hårstrå. De observerade att inom några sekunder efter att ha komprimerats rusade mitokondrierna i HeLa-cellerna till ytan av kärnan och började pumpa in extra ATP, cellernas molekylära energikälla.
”Detta tvingar oss att ompröva mitokondriernas roll i människokroppen. De är inte bara statiska batterier som driver celler, utan snarare smarta ’räddare’ som kan tillkallas i en nödsituation när en cell bokstavligen pressas till sina gränser”, säger Dr. Sarah Sdelchy, medförfattare till studien.
Mitokondrierna bildade en så tät "glöd" runt cellkärnan att cellkärnan pressades inåt. Detta fenomen observerades i 84 procent av de komprimerade HeLa-cancercellerna, jämfört med nästan noll i de flytande, okomprimerade cellerna. Forskarna kallade dessa strukturer NAM, för nucleus-associated mitochondria (kärnassocierade mitokondrier).
För att ta reda på vad NAM gjorde använde forskarna en fluorescerande sensor som tänds när ATP kommer in i cellkärnan. Signalen ökade med cirka 60 % bara tre sekunder efter att cellerna hade klämts ihop.
”Detta är ett tydligt tecken på att cellerna anpassar sig till stressen och omkonfigurerar sin ämnesomsättning”, förklarar Dr. Fabio Pezzano, studiens förste medförfattare.
Ytterligare experiment visade varför denna energiboost är viktig. Mekanisk kompression stressar DNA, vilket bryter strängar och trasslar ihop genomet. Celler behöver ATP-beroende reparationskomplex för att försvaga DNA-strukturen och komma åt skadan. Komprimerade celler som fick extra ATP reparerade sitt DNA inom några timmar, medan celler utan extra ATP slutade dela sig normalt.
För att bekräfta betydelsen av denna mekanism i sjukdomen undersökte forskarna även brösttumörbiopsier från 17 patienter. NAM-halos observerades i 5,4 % av kärnorna vid tumörens invasiva marginal, jämfört med 1,8 % i den täta kärnan – en trefaldig skillnad.
"Att vi hittade denna signatur i patientvävnad bekräftade dess betydelse utanför laboratoriet", förklarar Dr. Ritobrata (Rito) Ghose, studiens första medförfattare.
Forskarna kunde också studera de cellulära mekanismer som möjliggör den mitokondriella "översvämningen". Aktinfilament – samma proteintrådar som gör att muskler kan dra ihop sig – bildar en ring runt cellkärnan, och det endoplasmatiska nätverket drar samman den nätliknande "fällan". Studien visade att detta kombinerade arrangemang fysiskt håller NAM på plats och bildar en "halo". När forskarna behandlade cellerna med latrunkulin A, ett läkemedel som stör aktin, försvann NAM-bildningen och ATP-nivåerna sjönk kraftigt.
Om metastatiska celler är beroende av NAM-associerade ATP-utbrott, kan läkemedel som stör ställningen göra tumörer mindre invasiva utan att förgifta mitokondrierna själva eller påverka frisk vävnad.
"Mekaniska stressreaktioner är en dåligt förstådd sårbarhet hos cancerceller som skulle kunna öppna upp för nya terapeutiska metoder", säger Dr. Verena Ruprecht, medförfattare till studien.
Även om studien fokuserade på cancerceller, påpekar författarna att detta sannolikt är ett universellt fenomen inom biologin. Immunceller som passerar genom lymfkörtlar, neurontillväxtprocesser och embryonala celler under morfogenes upplever alla liknande fysisk stress.
”Där celler är under tryck skyddar energitillförseln till cellkärnan sannolikt genomets integritet”, avslutar Dr. Sdelchi. ”Detta är en helt ny nivå av reglering inom cellbiologin, vilket representerar ett fundamentalt skifte i vår förståelse av hur celler överlever fysisk stress.”
