
Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
Studien understryker behovet av celltypspecifika behandlingar mot HIV
Senast recenserade: 02.07.2025
Forskare vid University of Illinois har visat vikten av att rikta in sig på specifika celltyper vid behandling av HIV. Deras studie, publicerad i tidskriften Proceedings of the National Academy of Sciences, är en av de första som undersöker de differentiella eller celltypspecifika effekterna av HIV-latensmodulering på myeloidceller, en typ av immunceller som produceras i benmärgen.
Ett av de största hindren för att eliminera HIV-infektion är att hantera latens, det vill säga den period under vilken en infekterad cell ligger vilande och inte kan producera virus. Latenta HIV-celler samlas i kroppen på platser som kallas reservoarer. Latenta reservoarer är problematiska eftersom de kan börja producera virus när som helst.
Fullständig utrotning av sjukdomen skulle kräva att alla latenta celler avlägsnas från kroppen eller permanent resistens mot aktiveringsstimuli. Reaktivering kan dock utlösas av en mängd olika faktorer, inklusive signaler som styr myeloidcelldifferentiering.
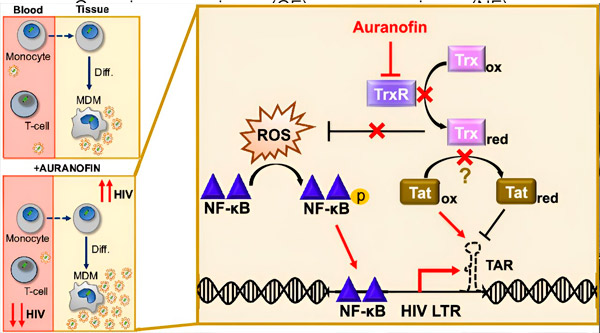
Reglering av HIV-latens i monocyt-deriverade makrofager (MDM) kan utgöra en risk för virusspridning. Differentiering av monocyter till makrofager kan utlösa HIV-reaktivering, vilket potentiellt främjar virusspridning i vävnader (överst till vänster). En klinisk kandidat, Auranofin, minskar viralt DNA i blod och främjar HIV-latens i T-celler och monocyter, men orsakar HIV-reaktivering i MDM (längst ner till vänster). I MDM antar vi att hämning av TrxR av Auranofin leder till ackumulering av reaktiva syreradikaler (ROS), vilket inducerar NF-κB-aktivering och aktivering av HIV LTR-promotorn (höger). Hämning av TrxR minskar potentiellt substratreduktion, vilket gör att Tat-proteinet kan förbli preferentiellt oxiderat, där det kan binda till TAR och initiera HIV-transkription. Källa: Proceedings of the National Academy of Sciences (2024). DOI: 10.1073/pnas.2313823121
I åratal har forskning om HIV-botande kretsat kring två metoder som kallas "chock och döda" och "blockera och låsa". Den förra fungerar i kombination med antiretroviral terapi för att aktivera latent infekterade celler och döda dem genom apoptos, eller programmerad celldöd, medan den senare tvingar infekterade celler in i ett djupt latent tillstånd från vilket de inte kan återaktiveras på egen hand.
Forskning kring dessa tekniker har traditionellt fokuserat på en typ av vita blodkroppar som kallas T-celler, vilka är det primära målet för HIV-infektion. Latenta reservoarer består dock av mer än bara T-celler; de innehåller faktiskt dussintals olika celltyper, var och en med sina egna unika mönster av HIV-genuttryck.
"Det finns en enorm mångfald av celler, även inom en enda celllinje", säger Collin Kieffer, biträdande professor i mikrobiologi och en av författaren till artikeln. "Variabiliteten i responsen i dessa reservoarer ökar med varje ny celltyp."
Alexandra Blanco, en doktorand i Kieffers laboratorium, ville studera celltyper som hade missats i traditionell HIV-forskning. Med fokus på myeloidceller skapade hon ett klonbibliotek innehållande 70 populationer av latent infekterade monocyter. Blanco analyserade sedan de klonala populationerna och deras reaktioner på aktivering. Reaktionerna varierade kraftigt, vilket belyser den stora mångfalden inom en enda celltyp.
Denna observation väckte en ny fråga: reagerar olika celltyper verkligen olika på HIV-latensbehandlingar? Deras resultat visade faktiskt att vissa HIV-latensbehandlingar kan främja latens i T-celler och monocyter, medan de kan reversera latens i makrofager.
"Inte alla celler i kroppen är likadana", sa Kieffer. "Så det är rimligt att inte alla infekterade celler reagerar på viruset på samma sätt."
Deras artikel belyser behovet av att framtida HIV-behandlingar beaktar alla celltyper och hur varje cell kan reagera på potentiella terapier.
Deras resultat bygger på forskning av Roy Dar, en tidigare professor i bioteknik i Illinois vars laboratorium studerade heterogenitet i HIV-genuttryck.
"Han startade det, och vi tog över det och byggde upp det till var det är idag", sa Kieffer. "Så samarbetet satte verkligen fart på dessa resultat. Det har gett oss en ny riktning, och vi är verkligen glada över det."
Ett ytterligare och oväntat fynd från Blancos analys avslöjade förändringar i cellstorlek och form som svar på infektion, vilket tyder på att HIV kan förändra cellmorfologin. Blancos nästa mål är att identifiera de biologiska mekanismerna bakom dessa fenotypiska förändringar.
Kieffer och hans laboratoriemedlemmar ser också fram emot att reproducera sina resultat, som mestadels gjordes i en cellinje, i primärceller. Att reproducera resultaten i en mer människoliknande modell skulle förbättra studiens kliniska relevans, förklarade Kieffer.
"Vi skulle vilja göra större screeningar i T-celler, monocyter och makrofager för att identifiera potentiella läkemedel som kan fungera på alla dessa celltyper", sa Blanco. "Vi kanske hittar ännu fler molekyler som inte beter sig på ett celltypspecifikt sätt."
