
Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
"Syre för celler": ett enkelt implantat hjälpte till att sänka sockernivåerna utan starka läkemedel
Senast recenserade: 18.08.2025
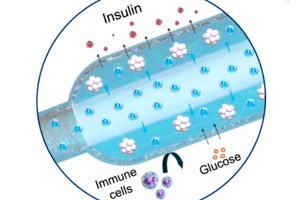 ">
">Ett nytt "syre"-implantat för behandling av typ 1-diabetes beskrevs i Nature Communications: en kompakt elektrokemisk syregenerator (iEOG) tillför kontinuerligt O₂ till en makrokapsel med insulinutsöndrande celler. Detta system möjliggör tät packning av isolerade cellöar (upp till 60 000 IEQ/ml) och bibehåller deras livskraft och utsöndring även vid låga syrehalter. Hos råttor med diabetes bibehöll den implanterade anordningen under huden normalt socker i upp till tre månader – utan immunsuppression. Kontrollråttor, utan syre, förblev hyperglykemiska.
Bakgrund
- Det största tekniska problemet är syre. Så snart vi "gömmer" cellerna bakom membranet och placerar enheten under huden (bekvämt och enkelt extraherat), saknar de syre: diffusionen genom membranet och det dåligt vaskulära området tillgodoser inte behoven hos de "glupska" cellöarna. Därav den tidiga döden, det svaga arbetet och behovet av att gallra ut sådden kraftigt - annars blir kapseln enorm.
- Varför är det så fysiskt svårt? Syre passerar bara genom vävnader över mycket korta sträckor, och inkapslade celler har inga egna kärl – de första månaderna lever de endast på grund av passiv diffusion. All förtjockning av material eller "kompaktering" av celler leder snabbt till hypoxi i kapselns centrum.
- Vad har du provat förut?
- De tillverkade makroenheter som kan påfyllas med syre (till exempel βAir): det finns en reservoar inuti som fylls på med syre dagligen; det gjordes prekliniska och tidiga kliniska prövningar. Det fungerar, men det är arbetskrävande för patienten.
- Kemiska O₂-donatorer och "bärar"-material (perfluorföreningar) prövades: de hjälper, men ger en kort och svårkontrollerad effekt. "Luft"-ramar för att accelerera O₂-tillförseln in i gelens tjocklek dök också upp.
- Kapslarna själva och implantationsställena (tunna membran, prevaskularisering) förbättrades, men utan en extern källa till O₂ stöter de fortfarande på celldensitetsgränserna.
- Vilken lucka i pusslet fyller det nya arbetet? Författarna till Nature Communications visar en kontinuerlig tillförsel av syre från en minigenerator mitt inuti makroinkapslingssystemet: enheten tar vatten från vävnaderna och frigör elektrokemiskt O₂, som jämnt "andas" längs kapseln med celler. Tanken är att ge kapseln sin "egen akvariekompressor" så att den kan packa fler celler och ändå hålla dem vid liv och fungerande – även på en subkutant, inte särskilt "syresatt" plats.
Varför är detta överhuvudtaget nödvändigt?
Ö- eller betacellstransplantation är en av de mest lovande vägarna till ett "funktionellt botemedel" för typ 1-diabetes. Men det finns två stora hinder:
- Immunitet - kräver vanligtvis livslånga immunsuppressiva medel;
- Syrebrist – kapslar som skyddar immunförsvaret stänger samtidigt av celler från blodkärlen, och betaceller, glupska efter syrgas, "kvävs snabbt". Det nya arbetet träffar den andra barriären: det ger kapseln sin egen, kontrollerade syrekälla.
Hur implantatet fungerar
- Två delar. I ett titanhölje finns en mini-syregenerator (iEOG), som extraherar vatten från interstitialvätskan och frigör O₂ genom elektrolys; bredvid den finns en tunn linjär kapsel med celler (liknande en lång "korv"), genom vilken ett gaspermeabelt rör passerar: syre absorberas jämnt längs hela kapseln. Mellan cellerna och vävnaderna finns ett semipermeabelt membran (elektrospinn + alginat): glukos och insulin passerar igenom, immunceller gör det inte.
- Mått: Den andra versionen av iEOG är 13 mm i diameter och 3,1 mm tjock och väger cirka 2 g. När det kombineras med en kapsel kan ett sådant system sättas in och tas bort genom ett litet snitt, vilket är viktigt för säkerheten.
- Produktivitet. Generatorn producerar ~1,9–2,3 cm³ O₂/h och upprätthåller det angivna flödet i månader och till och med år (i långtidsförsök i saltlösning – upp till 2,5 år), och efter implantation i råttor bibehölls denna nivå. Ett sådant flöde beräknas täcka behovet för hundratusentals öekvivalenter – den storleksordning som en person behöver.
Vad experimenten visade
- In vitro: Vid 1 % O₂ (allvarlig hypoxi) upprätthöll syresättningen livskraft och utsöndring i INS-1-aggregat och i humana cellöar packade i ett mycket tätt lager (60 000 IEQ/ml).
- In vivo (råttor). Efter subkutan implantation i en allogen diabetesmodell normaliserade iEOG-systemet glykemi i upp till 3 månader utan immunsuppression; anordningar utan syrgas hade ingen effekt. Histologi runt generatorn visade inga signifikanta biverkningar.
Varför är detta viktigt för kliniken?
- Ett steg mot ”realistiska dimensioner”. För att ge en vuxen en dos på 300–770 tusen IEQ måste kapseln vara tätt packad – detta har alltid begränsats av syre. Kontrollerad O₂-tillförsel ”tar bort taket” för densitet och ger en möjlighet att göra enheten tillräckligt kompakt för verklig implantation.
- Plus bekvämlighet. Tidigare provade vi kemiska syredonatorer (peroxider) – de fungerar inte länge och är okontrollerbara, liksom O₂-reservoarer med daglig "påfyllning" genom huden – besvärligt och obekvämt. Här tillförs syre konstant och i avmätta doser, utan injektioner.
Tekniska detaljer som imponerar
- Vattnets källa är vävnad. iEOG tar in ånga från interstitiell vätska genom ett poröst "fönster", och sedan används en klassisk membranelektrodenhet (MEA) och en spänning på 1,4–1,8 V för att separera vatten i H₂ och O₂; gaserna avlägsnas genom olika kanaler.
- Hållbarhet. Tre enheter i saltlösning fungerade i 11 månader, 2 år och 2,5 år med likström utan försämring av syreflöde; efter implantation i immunbristfälliga och immunkompetenta råttor bibehölls prestandan.
Begränsningar och "vad händer nu"
Detta är fortfarande prekliniskt: råttor, hög densitet i kapseln, syretillförsel - allt är bra, men viktiga tester ligger framför oss:
- skalning till mänskliga doser och tidsramar;
- tillförlitlighet och strömförsörjning hos elektrokemister i människokroppen i åratal (strömförsörjningsarkitekturen beskrivs inte i detalj i artikeln);
- minimering av fibros runt kapslarna och diffusionsstabilitet;
- tester på beta-stamceller och i modeller som är mer lik människor. Författarna jämför öppet sin lösning med tidigare metoder och positionerar den som en plattform för kliniskt översättbara kapslar.
Slutsats
För att transplanterade betaceller ska kunna leva och fungera utan immunsuppressiva medel behöver de andas. Teamet från Cornell och partners visade att en mini-syregenerator inbyggd i en linjär kapsel kan "mata" celler med O₂ tillräckligt länge och jämnt för att de ska kunna motstå hög densitet och minska socker även på en subkutan plats. Kliniken är fortfarande långt borta, men den tekniska logiken är enkel och vacker – ge cellerna luft där det saknas.
